
あなたは何を探していますか?
最初の3つの問題では、ヒトオリゴデンドロサイト前駆細胞 (OPC) 、脂肪由来幹細胞 (ADSC) の凍結保護におけるD ()-トレハロース二水和物の研究を共有しました。マウス精巣胚芽細胞などこれらの研究では、適切な量のD ()-トレハロース二水和物を凍結保存培地に添加するか、凍結保護剤 (CPA) を使用することがわかりました。 D ()-トレハロース二水和物とグリセロールを含むと、長期凍結保存後の細胞の回収率を向上させることができます。
この号では、に掲載された記事を通じて、3つの異なるヒト多能性幹細胞株におけるD ()-トレハロース二水和物の凍結保護効果について明確に理解しています。幹細胞研究イタリアのミラノの研究者による2018年。
D ()-トレハロース二水和物によるヒト多能性幹細胞の凍結保存
幹細胞を含む細胞療法製品は、高い臨床的可能性を持っています。 世界の幹細胞市場には、上流および中流の幹細胞の保管と準備、および下流の臨床アプリケーションが含まれます。 トランスペアレンシーマーケットリサーチ (TMR) のレポートによると、世界の幹細胞市場は2025年末までに2,705億米ドルに達すると予想されています。市場の複合年間成長率は、過去8年間で13.8% に達する予定です。
細胞治療製品のアプリケーションを確実にするために、細胞の長期凍結保存は、細胞の生存率と生化学的機能を長期的に保存するために利用できる唯一の方法であるため、細胞の長期凍結保存は克服しなければならない技術的困難です。
細胞内凍結によって引き起こされる細胞構造への損傷を避けるために、凍結保護剤が開発され、販売されています。 最も一般的に使用される細胞凍結保護剤は、ウシ胎児血清 (FBS) または任意の血清代替物と組み合わせたジメチルスルホキシド (DMSO) です。
ただし、FBSには、未知の病原体による人獣共通感染を引き起こす可能性のある異種動物由来のタンパク質が含まれています。 加えて、DMSOは細胞毒性である。 組織および細胞に対するDMSOの毒性は、曝露時間、温度、および濃度に直接関係していると報告されています。 毒性の程度は細胞の種類によって異なり、DMSOを除去せずに解凍した細胞で再注入された患者では副作用が報告されています。 さらに、DMSOは、3つのDNAメチルトランスフェラーゼ (Dnmts) の転写レベルを調節し、ゲノム全体のメチル化プロファイルを変更することにより、マウス胚のエピゲノムに影響を与えることが知られています。これは、マウス幹細胞の制御されない分化につながります。 これらの理由のすべてのために、DMSO + FBSは臨床使用に適していない。 効率的で非毒性の凍結防止剤を開発することが急務である。
D ()-トレハロース二水和物は、細菌、酵母、クマムシ、線虫など、完全な脱水を生き残ることができるさまざまな生物に見られる非還元二糖です。 哺乳類はD ()-トレハロース二水和物を生成しませんが、氷の結晶形成によって引き起こされる細胞の損傷を減らすことができる哺乳類細胞の効果的な凍結保護剤です。 D ()-トレハロース二水和物の保護効果は、浸透圧効果と細胞膜リン脂質および不安定なタンパク質の特異的相互作用に関連しています。乾燥や酸化ストレスによる細胞の損傷や変性を防ぐことができます。
非細胞毒性D ()-トレハロース二水和物は、マウス精子細胞、成体造血幹細胞、間葉系幹細胞などのさまざまな種類の細胞の凍結保存に効果的に使用されています。脂肪由来幹細胞 (ADSC) 、ヒト胚性幹細胞 (hESC) 、およびヒト誘発性多能性幹細胞 (hiPSC)。 D ()-トレハロース二水和物は、臍帯血、骨髄、およびヒトの小島の凍結保存にも使用されます。
細胞保存におけるD ()-トレハロース二水和物の広範な使用を妨げる主な障害は、D ()-トレハロース二水和物が細胞の内部にアクセスするのが難しいことです。 浸透圧ショック、リポソーム送達、熱穿孔、エレクトロポレーション、マイクロインジェクション、遺伝子工学など、この問題に対処するためにいくつかの手段が以前に適用されてきました。 しかし、上記の方法は複雑な操作を必要とし、面倒で時間がかかり、重大な細胞損傷につながる可能性があります。
この研究では、3つの異なるタイプの多能性幹細胞株が、D ()-トレハロース二水和物を単独で、またはエチレングリコールまたはグリセロールと組み合わせてそれぞれ使用して調製された4つの異なる凍結保護剤で凍結保存されました。 次に、細胞株を解凍して、細胞形態、解凍後の生存率、多能性マーカー発現レベル、ゲノム安定性、小胞体 (ER) 恒常性、DNA損傷応答などの主要なパラメーターを調査しました。極低温保護キャップの測定多能性幹細胞に対する4つの凍結保護剤の活性度。
異なるCryoprotectant成分
グループ | コンポーネント |
A | 0.5 M D(+)-トレハロース二水和物 |
B | 0.5 M D(+)-トレハロース二水和物 + 2.5% エチレングリコール |
C | 0.5 M D(+)-トレハロース二水和物 + 10% エチレングリコール |
D | 0.5 M D(+)-トレハロース二水和物 + 10% グリセロール |
全ての凍結保護剤を新たに準備し、リン酸緩衝生理食塩水 (PBS) で希釈した。 研究で使用した細胞は、CS10を使用して凍結保存した。 10% DMSOを含むCS10は、血清および動物成分を含まない凍結保護剤であり、ヒト多能性幹細胞 (hPSC) の凍結保護に推奨されます。
特定の条件下で細胞を培養する。 0.5 mM EDTAでhESCs-RC17を分離し、hiPSCs-CTR2 #6とltNES-AF22を細胞剥離溶液で処理し、新たに準備された凍結保護剤 (A、B、C、およびD) で保存します。 2.0 × 10 ^ 6細胞を各凍結保護剤1.5mLに再注入し、極低温バイアルに移します。
冷凍容器で極低温バイアルを約-1 ℃/分で冷却し、一晩保管した後、-80 ℃ で冷凍庫に移します。 24時間後、低温バイアルを液体窒素に移し、少なくとも1週間保管します。
極低温バイアルを37 ℃ の水浴で氷の塊が消えるまで温め、細胞懸濁液を温かい培地で希釈します。 3分間の遠心分離によって200 gの組織の細胞を収集し、示された接種サイズで各細胞タイプに適したコーティングされた培養容器に種をまきます。
① 細胞の生存率
解凍から48時間後にエージェントアラマーブルーで細胞の生存率を測定します。
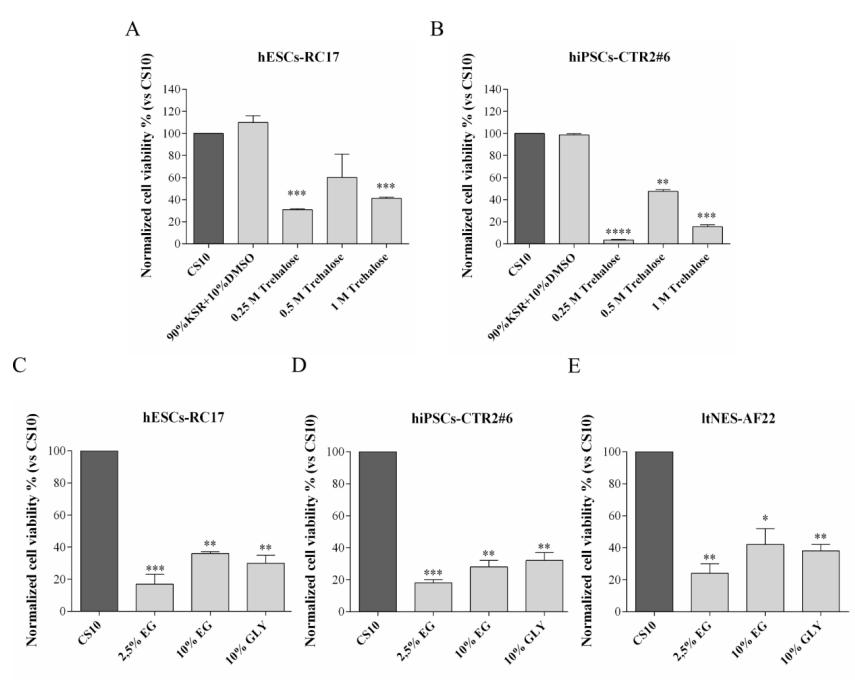
まず、D ()-トレハロース二水和物、エチレングリコール、およびグリセロールの適切な量を決定するために、さまざまな幹細胞株にさまざまな濃度の単一成分溶液を使用しました。 解凍後の細胞の生存率を測定し、対照群と比較した。 結果は、0.5 M D ()-トレハロース二水和物、10% エチレングリコール、10% グリセロールが適切な量であることを示しましたが、幹細胞の種類によって大きな違いがありました。
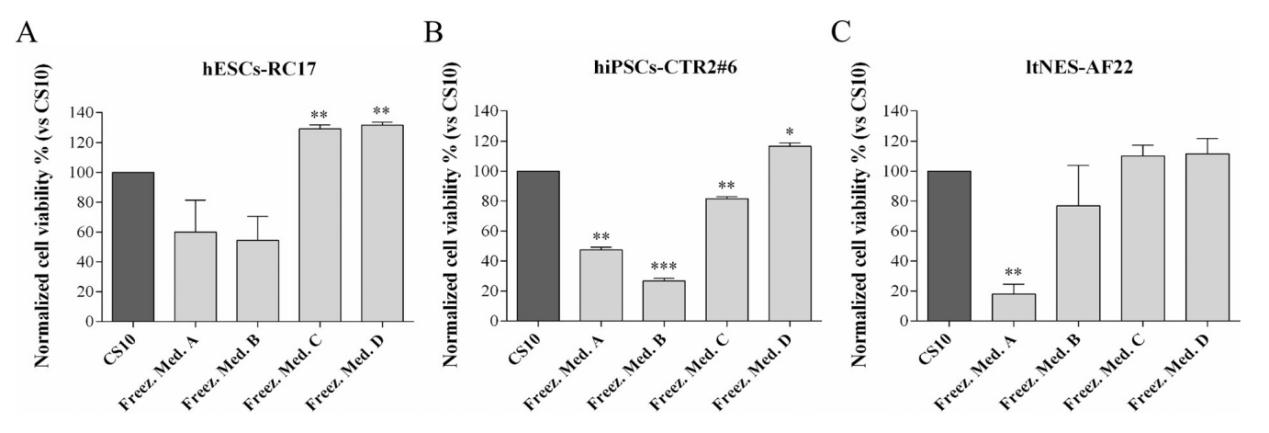
初期濃度を決定した後、4つの異なる凍結保護剤 (上記を参照) を3つの幹細胞株の凍結保存に使用しました :( グループA) hESCs-RC17、 (グループB) hiPSCs-CTR2 #6、および (グループC) ltNES-AF22。 解凍後に細胞の生存率を測定した。 細胞生存率はまた、同じ条件下でCS10に凍結保存された同じ細胞と比較されました。
細胞をD ()-トレハロース二水和物のみで凍結保存すると (グループA) 、解凍後の細胞の回収率は低下し、細胞タイプごとに20% から60% に変化しました。
D(+)-トレハロース二水和物ベースの培地に10% エチレングリコールまたは10% グリセロール (グループCおよびD) を補充した場合、hESCs-RC17とltNES-AF22の細胞生存率は、DMSOで凍結保存されたものと同様のレベルに達しました。 しかし、グリセロール中で凍結保存されたhiPSCs-CTR2 #6の細胞生存率は、エチレングリコール中のそれよりも良好であった。
さらに、エチレングリコールまたはグリセロールのみを含む対照凍結保護剤との結果を比較すると、生存率の増加は、エチレングリコール/グリセロール + D(+) の複合効果によるものであることが確認された。-トレハロース二水和物。
これらの結果は、D ()-トレハロース二水和物がヒト多能性幹細胞の凍結保存に使用でき、DMSOに取って代わることが期待されていることを示唆しています。10% エチレングリコールまたは10% グリセロールを添加すると、トレハロース凍結防止剤の生存率を大幅に向上させることができます。 平均細胞生存率はCS10と比較して増加した。 エチレングリコール/グリセロールおよびD ()-トレハロース二水和物の凍結保護剤は血清タンパク質を含まず、多能性幹細胞の早期分化を刺激する以前に報告されたリスクを回避します。
① 細胞形態
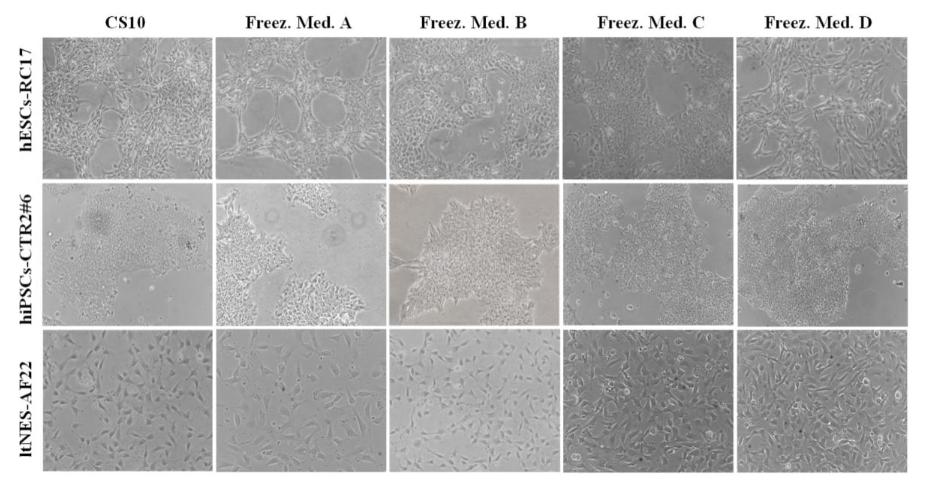
もう1つの懸念幹細胞の凍結保存は、染色体および多能性の変化です。 凍結と解凍の間に、氷の結晶と泡が細胞の内外で形成され、紡錘体微小管を破壊して異常な染色体分離を誘発し、細胞成長の特徴と形態に変化をもたらす可能性があります。 したがって、染色体への損傷の可能性と幹細胞の多能性は、解凍後の細胞の形態を観察することによって容易に評価することができます。
上の図は、解凍後48時間のhESCs-RC17、hiPSCs-CTR2 #6、ltNES-AF22の細胞形態を示しています。 位相コントラスト画像は、複合D( )-トレハロース二水和物凍結保護剤がどの細胞株にも有意な形態学的変化を引き起こさず、細胞の形態がCS10に保存されている細胞の形態と同一であることを示しました。
① マーカー式レベル
解凍後のhESCs-RC17、hiPSCs-CTR2 #6、およびltNES-AF22が多能性幹細胞の重要な特性と特性を保持していることを確認するために、解凍後48時間の定量RT-PCRでいくつかのマーカーの発現レベルを分析しました。
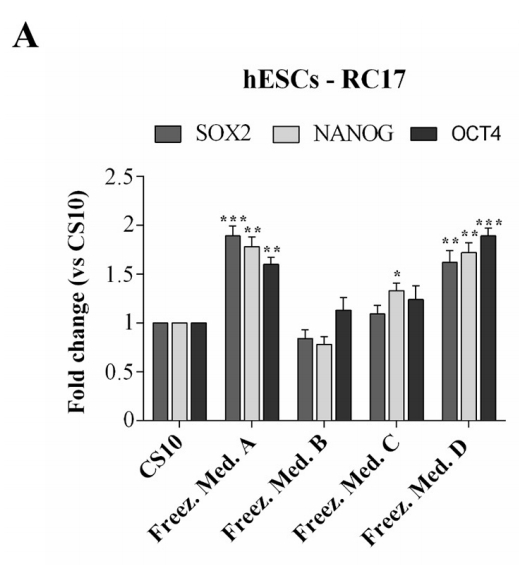
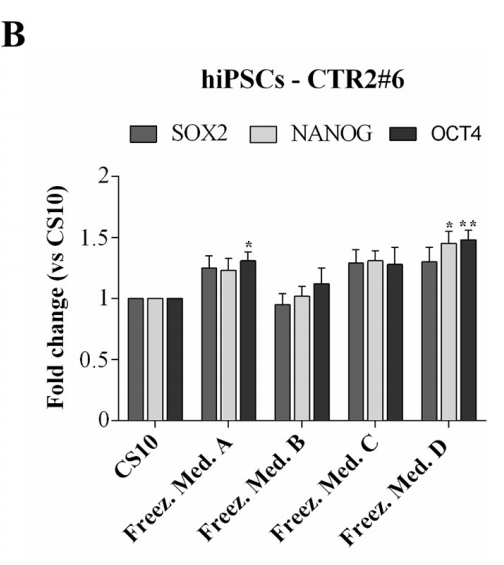
細胞マーカーNanog、Oct4およびSox2を、hESCs-RC17およびhiPSCs-CTR2 #6について検出し、対照群と比較した。
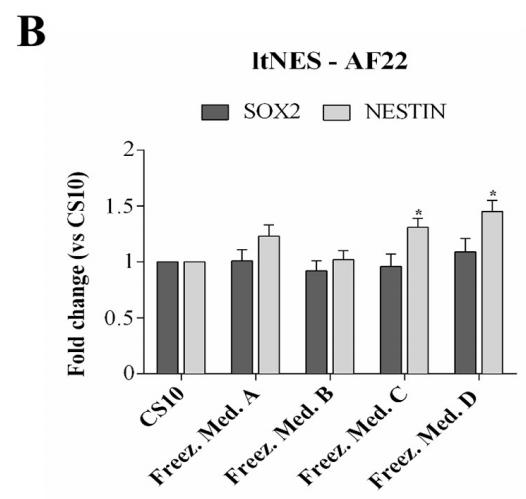
NestinおよびSox2をltNES-AF22について検出し、対照群と比較した。 結果は、幹細胞分化能が影響を受けていないことを示した。
① 染色体安定性
幹細胞の染色体安定性に対するD( )-トレハロース二水和物ベースの凍結保護剤の効果を評価するために、従来の核型分析とaCGHを3つの幹細胞株すべてで実施しました。 下の図は、凍結保存の前後のltNES-AF22の結果を示しています。
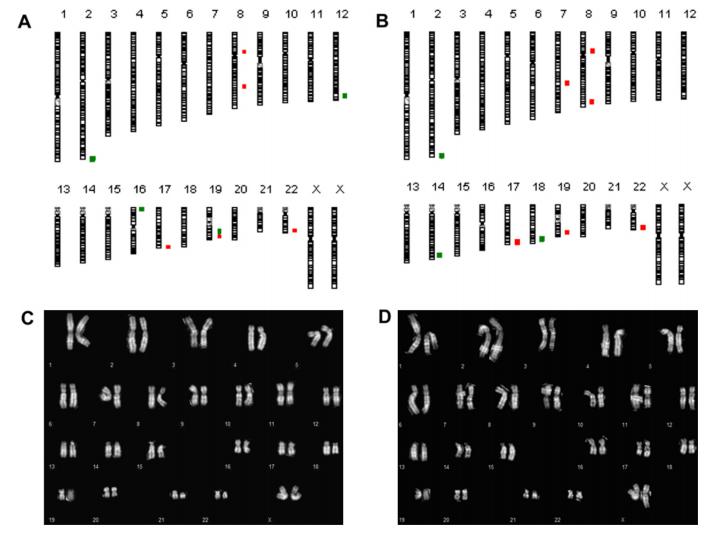
全体として、核型は安定したままであったが、コピー数の変化 (CNV) が検出された (染色体2、8、19、および22)。 CNVのいくつかは一次細胞に存在していた可能性があり、他のものは凍結保存ではなく細胞のin vitro操作中にランダムに発生した可能性があります。クローン異数性または構造染色体異常は、凍結保存の前 (図C) および後 (図D) に観察されなかったためです。
① ERストレス/展開されたタンパク質レベル評価
この研究はまた、CS10またはD( )-トレハロース二水和物の凍結保存が、小胞体 (ER) ストレスに反応し、折りたたまれていないタンパク質応答 (UPR) を活性化する多能性細胞の能力に影響を与えるかどうかにも焦点を当てました。 さまざまな生理学的または病理学的状態で恒常性を維持するために、ERはさまざまな分子および細胞シグナルを統合します。 ERストレスとUPRはどちらも、細胞の増殖、分化、アポトーシスに影響を与える分子的および生化学的メカニズムを仲介します。
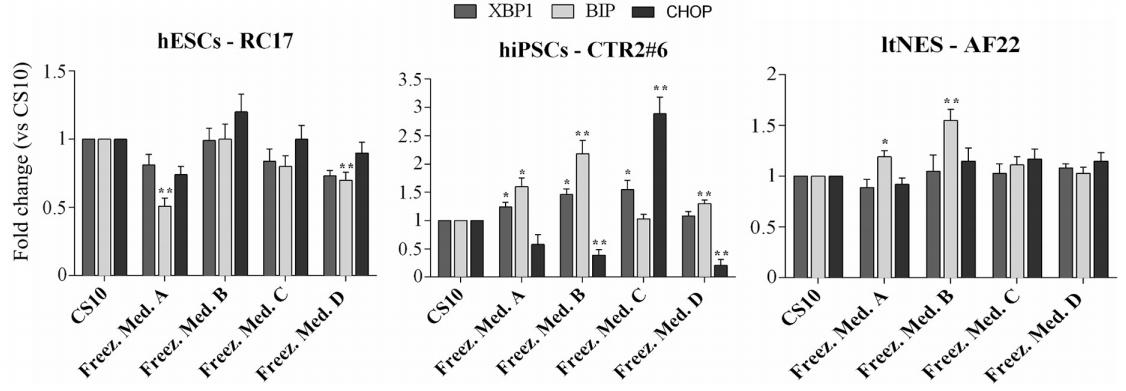
全体として、D( )-トレハロース二水和物は、CS10と比較して中程度のレベルのERストレス/UPRを示しました。 より感度の高い細胞株はhiPSCs-CTR2 #6であり、グループBおよびCでより高いBIPおよびCHOP遺伝子発現レベルを示し、Dによる凍結保存を示しています ( )-トレハロース二水和物は、CS10と比較して、多能性幹細胞のER恒常性を有意に変化させませんでした。
幹細胞の長期凍結保存は、細胞移植や細胞治療などの多くの分野で大きな応用の可能性を秘めています。 いくつかの研究は、ヒト多能性幹細胞の凍結保存の手段を最適化しており、D( )-トレハロース二水和物による長期凍結保存は理想的な方法かもしれません。
D( )-トレハロース二水和物凍結保護剤で保存されたヒト多能性幹細胞は、細胞の表現型と機能特性を維持し、臨床療法におけるD( )-トレハロース二水和物の潜在的な用途を示しています。 複合D( )-トレハロース二水和物凍結保護剤、D( )-トレハロース二水和物とエチレングリコールまたはグリセロールの組み合わせで凍結保存された細胞のバイオセーフティを評価するには、さらなる研究が必要ですが、細胞毒性や動物由来のタンパク質を持たないバイオセーフティ凍結防止剤として、臨床応用に大きな期待が寄せられています。